您现在的位:首页 > 新闻动态 > 公司新闻 > 公司新闻
2018诺贝尔化学奖解析: 当KAPA插上“进化”的翅膀,我们的征途便是星辰大海
来源:东岱科学器材日期:2018-10-09 14:50:00浏览次数:次

图片来源于瑞典皇家科学院
2018 年的诺贝尔化学奖授予了弗朗西斯·阿诺德(Frances Arnold),乔治·史密斯(George Smith)和格雷格·保罗·温特(Gregory Paul Winter),表彰他们在酶的定向进化,以及多肽与抗体的噬菌体展示技术领域的贡献。
虽然化学奖授予了3个在生物学领域有突出贡献的科学家这事儿挺稀奇的,但是这种跨界却也无可厚非,表面上看上去毫无关联,但内核却息息相通,这些创新技术的背后都是亘古不变的生物生存法则——进化,而进化的本质在化学层面上就是基因变异,进而导致蛋白质在分子层面上发生改变,产生新的物种,造就丰富多彩的世界。成功者上位曰为“进化”,失败者则出局淹没在浩瀚的历史长河中,这就是自然法则。三位科学家的伟大之处就是巧妙的利用了自然法则,不仅向自然学习,更超越了自然,应用这个法则来造福芸芸众生。其中,Frances发明的“定向进化”(Directed Evolution)技术通过对野生酶进行基因工程改造,实现了酶的定向进化,可高效获得符合不同应用场景所需的酶;而George和Gregory的主要贡献是开发了一种叫做“噬菌体展示”(Phage Display)的技术,利用噬菌体来表达感兴趣的基因,进而对这些蛋白质进行高效筛选和进化,用于更好的开发抗体药物。
你可能会觉得这些技术听上去都挺高大上的,但和我们的生活有什么关联呢?远的不说,今天就来详细解析一下“定向进化”技术及其在新一代测序技术(NGS)上的小应用。
众所周知,当今医学技术已经跨入了“精准医学”(Precision Medicine)时代,和“经验医学”(Empirical Medicine,第一代)及“循证医学”(Evidence-based Medicine,第二代)所不同的是,精准医学非常强调个体化的精准诊断和治疗,同病可异治(Umbrella Trial),异病也可同治(Basket Trial),前者追寻相似的疾病表征下是否有不同的基因驱动机制以及因人而异的治疗策略,使患者得到更适合的治疗;后者则关注不同疾病背后是否有相同的基因驱动机制以及有没有现有的治疗手段可以应用,让患者得到更及时的治疗。但无论是同病异治还是异病同治,都离不开NGS技术的崛起和进步,毫不夸张的说,没有NGS技术就没有精准医学。
同样,NGS技术也离不开几个核心的基础技术,高保真聚合酶就是其中的“关键先生”之一,而我们今天的主角——定向进化——就是获得高性能高保真聚合酶的技术保障,业内目前普遍认可的 KAPA HiFi 系列高保证聚合酶的诞生即得益于“定向进化”的强大威力。
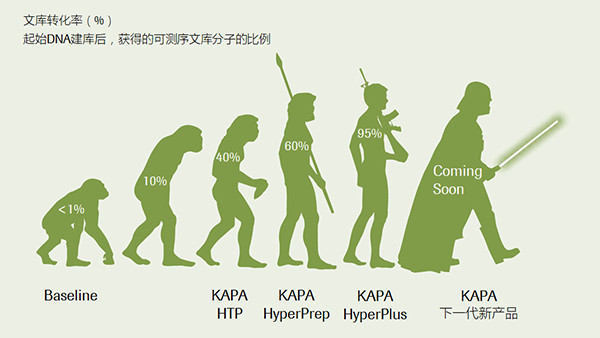
“定向进化”技术带来的文库转化效率的提升。此处采用“文库转化率”这个关键指标来评估建库的整体效率,转化率越高,建库效率也越高。(数据来源于罗氏诊断总部)
那么,何为“定向进化”技术呢?
简而言之,就是开了挂的人工进化技术。无论是自然进化还是定向进化,都是特定基因的突变或重组,进而产生多样化的蛋白质,通过自然筛选产生多样化的生命。但自然进化和定向进化的区别就是,前者的过程是极其缓慢的、不可控的。地球经历了40多亿年才孕育出如今的文明,相比之下,人类短暂的生命只是沧海一粟,又能经历多少等待呢?Frances Arnold给出的答案就是后者——定向进化——只争朝夕!KAPA也正是通过这种在实验室模拟和加速野生酶的自然进化过程,成功地将自然进化的效率提升了几百万倍,获得了一系列性能优异的工程酶,包括高保真聚合酶,多重PCR聚合酶,耐受PCR抑制的聚合酶,片段化酶,连接酶,反转录聚合酶等等。
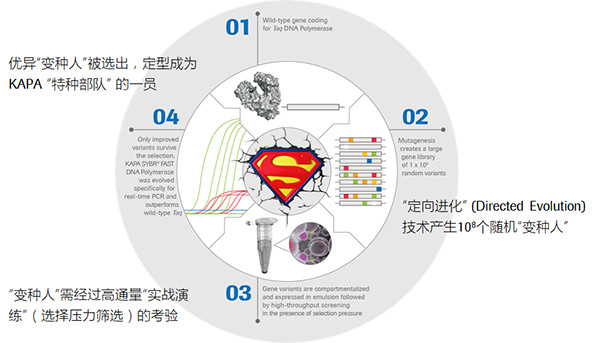
KAPA 酶的定向进化历程
这些酶的“定向进化”往往会经历以下几个步骤:
· 对野生酶的编码基因序列进行随机变异,产生一个变异序列库,约包含上亿个变种序列。
· 变种序列被转染到大肠杆菌的基因组中,每个单克隆都被包裹在一个微小的液滴中进行孵育和表达。由于大肠杆菌具有培养简单、复制快、可高效表达植入的基因等特性,因而可高通量的获得一系列按照不同变种序列翻译而来的变种酶。
· 施加各种生存压力(如高温、抑制剂、低容错等等)至反应体系,选择性地筛选出最适应压力环境的变种酶。
· 循环往复地重复上述步骤,每次选出相对最好的酶进行下一轮进化,来不断优化和提升酶的特定性能,直至满足相应的应用场景。
这些方法听上去是不是都挺普通的?但是进化的成果却不容小觑。接下来我们就以 KAPA HiFi 高保真聚合酶和 KAPA SYBR FAST 聚合酶为例,展示一下“定向进化”的威力吧。
高保真酶,顾名思义,就是要求聚合酶在PCR扩增中,既要保证扩增的高准确度,也能兼顾扩增效率的基本特性。高准确度往往就体现在较低的扩增错误率(即碱基错配比例)和较高的扩增均一性(即扩增偏好较小,不易受到基因组GC碱基含量的改变而带来扩增效率的改变)这两方面。经过定向进化得来的 KAPA HiFi酶就拥有这样的优良特性,不仅扩增产量高、片段长,而且错误率低和扩增偏好小,非常适合NGS应用。
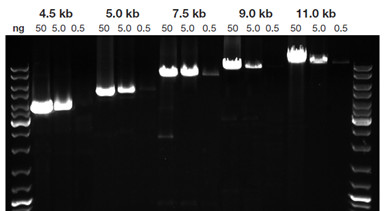
KAPA HiFi 扩增长 hgDNA 片段的表现
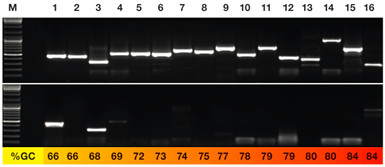
KAPA HiFi 酶(上)和 Phusion 酶(下)扩增高GC含量模板的表现
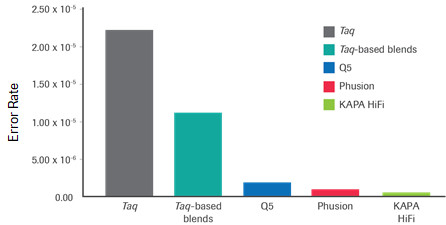
KAPA HiFi 酶的碱基错配率及和其他高保真酶的比较
(以上数据均来源于罗氏诊断总部)
KAPA SYBR Fast 聚合酶,也顾名知其意,是一种能够耐受高 SYBR Green 染料的聚合酶。SYBR Green 染料是一种能和双链DNA结合,在特定激发光下发射荧光的染料,常被用来作为PCR的指示剂。因其易得、成本低廉和适用范围广的特性,已被广泛应用在分子生物学的各个领域。但这种染料也有其缺点,那就是会对DNA聚合酶产生一定的抑制作用,造成扩增效率的下降。经过定向进化得来的 KAPA SYBR Fast 聚合酶就拥有克服这种抑制的优良特性,无论在低浓度或是高浓度的 SYBR Green 环境下,均有稳定的扩增效率表现,这种特性可帮助用户采用更高浓度的SYBR Green染料,从而获得更高的荧光信号,改善信噪比,降低检出的灵敏度,增加定量的线性范围。
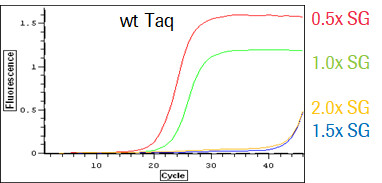
野生聚合酶在高浓度SYBR Green环境下呈现扩增抑制,以及染料浓度和荧光信号强度之间产生倒挂的问题。
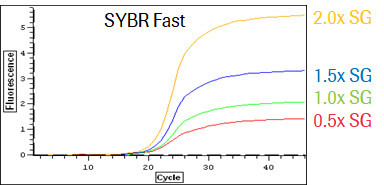
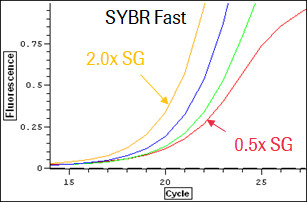
KAPA SYBR Fast 在高浓度SYBR Green环境下不仅耐受抑制,而且染料浓度和荧光信号强度呈正比。
正是有了这些通过“定向进化”得来的高性能酶,才使得 KAPA NGS样品制备产品家族的成员从众多同类产品中脱颖而出,成为行业普遍认可的佼佼者,无论是 KAPA HiFi 还是 KAPA SYBR Fast 都已经成为了 KAPA 文库制备试剂盒以及文库定量试剂盒的“灵魂”。
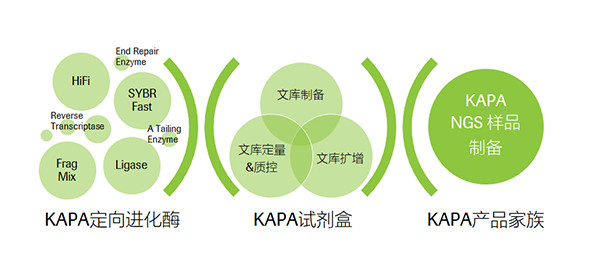
定向进化技术是KAPA产品家族的“灵魂”
高品质NGS应用酶,带来的不仅仅是NGS应用体验上的改善,更可帮助用户从困难样本中获得高质量的NGS数据,从而克服终端应用的各种挑战,这些困难样本包括:
· 起始量低,如细胞游离DNA(cfDNA),循环肿瘤DNA(ctDNA),单细胞(Single Cell),穿刺样品(Fine-needle Aspirate)和拭子样品(Swab)等
· 降解程度高,如福尔马林固定-石蜡包埋样品(FFPE)等
· GC含量变化大,如微生物和植物样品等
· 异质性高、成分复杂的样品中检测低频变异或低丰度转录本,如肿瘤样品等
这些挑战背后往往伴随的是以下样品制备上的困难:
· 可测序分子含量少,往往不够测序仪的上机要求。
· 携带关键信息的分子含量更少,易被无效的序列或重复的序列信息所淹没,或因各种制备上的局限性而丢失。
· 同一样品中的不同部分难以获得相似的文库转化和扩增效率,建库前后的差异性较大,难以还原原始样品。
· 不同样品的文库混合上机测序时难以获得“等摩尔混合”的效果,不仅达不到测序芯片的最佳成簇密度,造成通量浪费,而且也容易造成不同样品的数据产出量不均,影响后续生物信息学分析。
KAPA采用定向进化技术,可从根本上去克服这些样品制备上的困难:
· 高文库转化和扩增效率,意味着低起始量样品、降解样品、或者携带关键信息的序列只需较少的PCR循环数即可达到上机要求的文库产量,不仅有效保留了关键信息,而且不会产生过多的重复序列,既节省了测序通量,又放大了关键信息。
· 高保真度和低扩增偏好,意味着更广的目标区域覆盖度和更均一的测序深度,不易遗漏关键点,也更能还原样品本身,降低后端生信分析的难度。
· 高 SYBR Green 耐受度,意味着可提高荧光染料浓度来获得更灵敏、更稳定的PCR检测信号,增加定量和质量评估的准确性。
· 随机的酶切片段化,意味着近似物理打断的片段化效果,可满足大通量、自动化应用的需求。
接下来就用两个困难样品的应用实例来佐证KAPA的实力吧。
KAPA RNA Hyper+RiboErase Kit 在 FFPE-RNA样品制备中的应用
如今,肿瘤FFPE-RNA测序得到了越来越多的关注,因为其中携带的基因融合变异信息,无论在诊断还是治疗层面上都非常有价值。
众所周知,RNA相比DNA更易降解,所以RNA样品的质量直接关乎NGS测序数据的质量。在RNA测序的各种应用中,FFPE-RNA测序无疑是“Mission Impossible”的存在,不仅是因为高度降解的缘故,完整的RNA分子含量非常有限,也是因为总RNA样本中本身就有约90%都是无用的核糖体RNA(rRNA)序列,易干扰到有价值的变异信息的检出。因此,FFPE-RNA样品制备前,通常需要进行样品质量的评估。常用的方法是用核酸分析仪对FFPE-RNA样品进行检测,用DV200指标来评估样品质量的好坏,DV200即长度超过200bp的RNA序列在所有RNA序列中的占比,DV200的百分比越高,样品的质量就越好。
我们分别测试了DV200在6%~95%之间的若干个 FFPE-RNA 样品,通过 KAPA RNA Hyper+RiboErase Kit 建库后的表现(这是一款可以对rRNA进行消除的高性能RNA建库产品)。
在样品评估阶段,我们发现RNA质量对最终的文库产量影响很大,DV200越低,最终建库后的文库得率也越低,接头连接效率也越低。
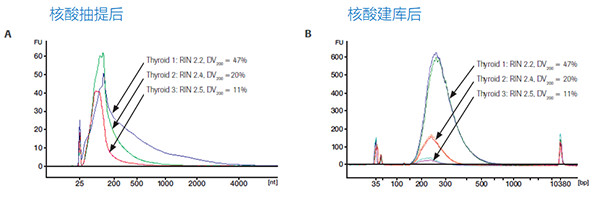
RNA质量对最终文库得率的影响。A)3种不同质量的FFPE样品抽提后的RNA长度分布。B)A中3种样品各取25ng通过KAPA RNA Hyper Kit(无RiboErase富集模块)进行建库后的得率和长度分布,每个样品各1个重复。不难看出,质量越好的样品,文库得率越高,而DV200低于11%,已经不值得再进行NGS测序。(数据来源于罗氏诊断总部)
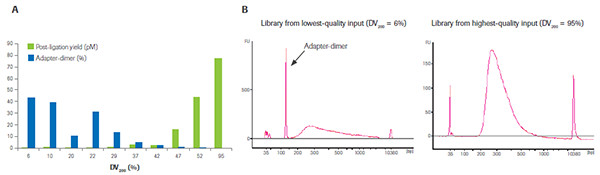
RNA质量对最终接头连接效率的影响。A)取不同质量的FFPE-RNA样本(DV200在6%-95%之间)各100ng,通过KAPA RNA Hyper+RiboErase Kit进行建库后接头连接效率的评估,蓝色为接头聚合体含量,绿色为可测序文库含量,可见质量越低,越难获得有效的测序文库,大多情况下获得的都是接头聚合体的扩增产物,如B)中所示,而仅仅采用荧光定量的方法来评估最终文库的产量,是非常片面的,极易导致NGS测序失败。(数据来源于罗氏诊断总部)
基于以上认识,我们设计了如下的实验方案,摸索了针对不同样品质量的最优建库流程。(数据来源于罗氏诊断总部)
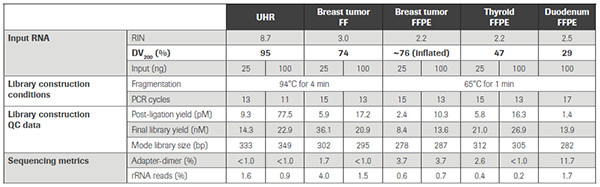
以下是 KAPA RNA Hyper+RiboErase Kit 针对不同质量样品的建库表现。不难看出,无论样品质量和起始量的高低,KAPA试剂盒均表现出了较高的建库效率。在文库得率,上靶率,Unique转录本检出数,PCR重复率、测序覆盖均一性及重现性等关键指标上,均表现出色。
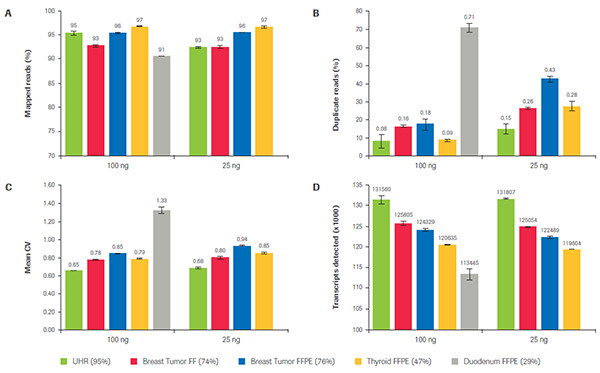
KAPA RNA Hyper+RiboErase Kit 针对不同质量FFPE-RNA样品的建库表现。不同颜色代表了不同质量高低的样品,从左往右,样品质量依次降低。在不同样品质量和不同起始量的条件下,比较了A)Reads上靶率,B)重复Reads比例,C)覆盖均一性,以及D)Unique Reads检出数。KAPA均显示出了高度的一致性和建库效率。(数据来源于罗氏诊断总部)
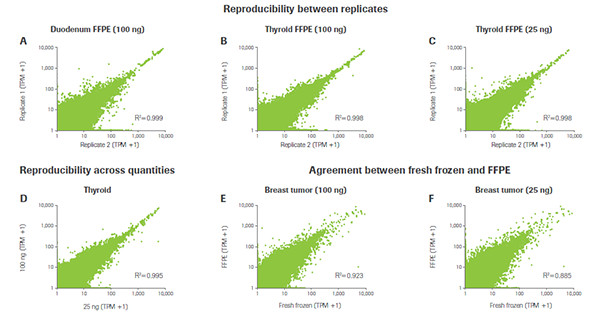
KAPA RNA Hyper+RiboErase Kit 针对不同重复之间的相关性表现。无论在什么样品质量的条件下,KAPA在同一样品的不同重复之间均显示出了极高的相关性(如A、B、C所示);在同一样品的不同起始量重复之间也显示出了极高的相关性(如D所示);在同一类型样品,不同RNA质量重复之间(FFPE vs. 新鲜冰冻)也均显示出了极高的相关性(如E、F所示)(数据来源于罗氏诊断总部)
KAPA Hyper Plus Kit 在微生物样品制备中的应用
目前,有不少科研用户或自动化平台用户更倾向于酶法来代替物理打断法进行DNA片段化。因为前者不仅对硬件的要求低,流程体验更简化,而且同时提高了文库转化率,可谓一举两得。酶法片段化又可分为转座酶片段化和混合酶切片段化两种主流的方法学。基于转座酶片段化技术的微生物NGS文库构建,常有三个恼人的局限性:
· 片段长度控制不佳,对 DNA 起始量敏感
· 文库转化效率较低
· 序列起始位点偏差大(与片段化技术相关),高挑战区的扩增偏好明显(高GC或AT含量区)
这些局限性限制了样品的起始量和类型,降低了起始DNA转换为可测序文库的效率,以及文库Reads的多样性,从而影响覆盖深度和均一性,最终影响测序数据质量和 de novo 测序的基因组完整性。
使用KAPA Hyper Plus 文库制备试剂盒则可有效克服上述困难,相比同类产品,可获得更高的文库产量,片段长度适中,片段化起始位点偏差小,困难区域扩增偏好性小,覆盖深度及均一性表现良好等特性,在3种GC含量不同的细菌样品间的一致性好,性能更稳定。
我们设计了如下实验方案,均按照标准流程操作。结果如下。(数据来源于罗氏诊断总部)
首先是文库产量和片段长度分布,不难看出KAPA试剂盒在经历同类产品相当的PCR循环数之后,可测序文库产量要高出同类产品数倍,且片段长度适中,GC含量对产量的影响相对最小,体现了较高的建库效率。
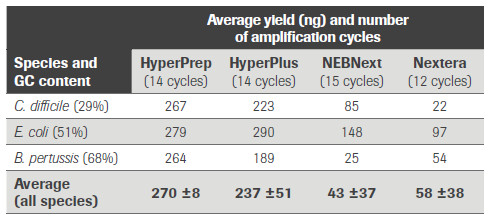
KAPA 文库制备产品和同类产品对GC含量不同的3种微生物基因组样品的文库转化效率的比较。(数据来源于罗氏诊断总部)
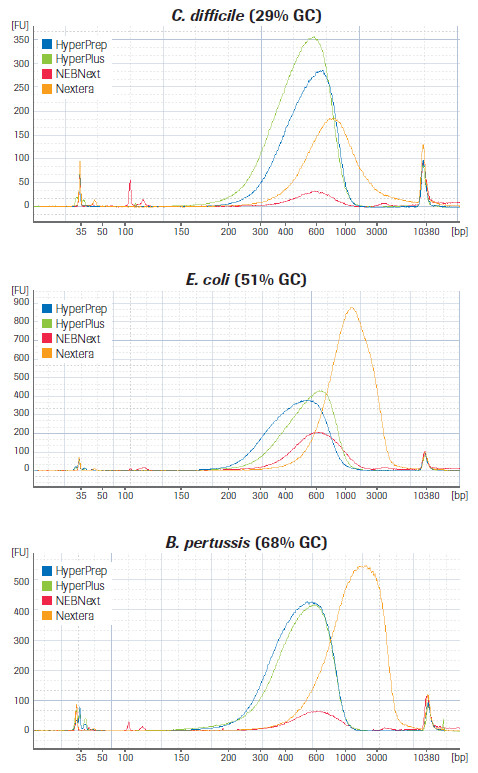
KAPA 文库制备产品和同类产品对GC含量不同的3种微生物基因组样品的文库片段长度的分布比较。(数据来源于罗氏总部)
其次,在酶法片段化的偏好性上,KAPA Hyper Plus 的片段化的随机性最接近物理打断的效果,偏好性为同类产品最低。
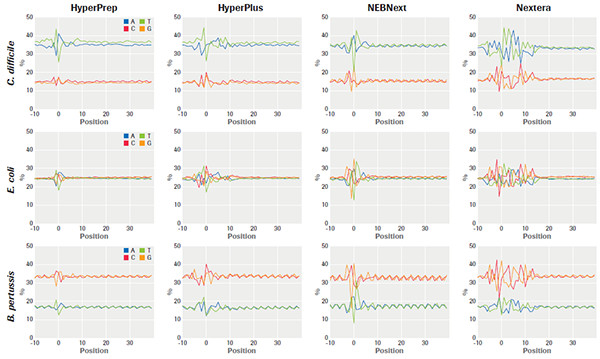
KAPA 文库制备产品和同类产品对GC含量不同的3种微生物基因组样品的片段化起始位点偏差比较,机械片段化+HyperPrep 偏差最小,HyperPlus 比其他转座酶片段化产品的偏差都要小,且在GC含量不同的样品中显示出高度一致性。(数据来源于罗氏诊断总部)
第三,在测序均一性等指标上,KAPA 试剂盒均表现出良好的测序深度和覆盖均一性,受GC含量的影响最小。
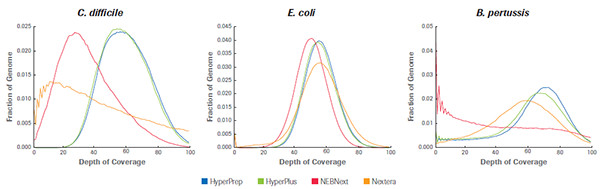
KAPA 文库制备产品和同类产品对GC含量不同的3种微生物基因组样品的覆盖深度比较, HyperPrep 和 HyperPlus 比其他产品的覆盖深度都要高,且在GC含量不同的样品中显示出高度一致性。(数据来源于罗氏诊断总部)
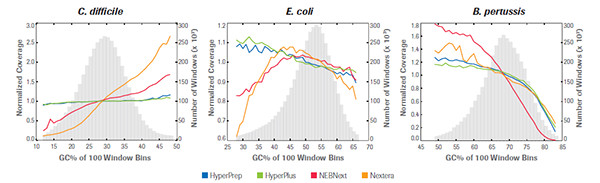
KAPA 文库制备产品和同类产品对GC含量不同的3种微生物基因组样品的GC偏好性比较, HyperPrep 和 HyperPlus 比其他产品在GC含量不同的样品中均显示出较好的无偏性,其他产品为了达到较好的AC-,GC-区域覆盖均一性,需要消耗较多的测序通量,因而时间和成本都显著增加。(数据来源于罗氏诊断总部)
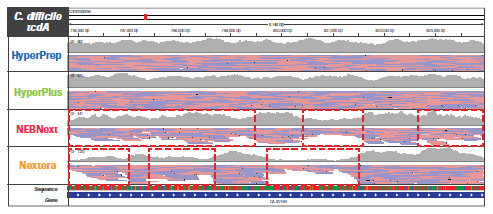
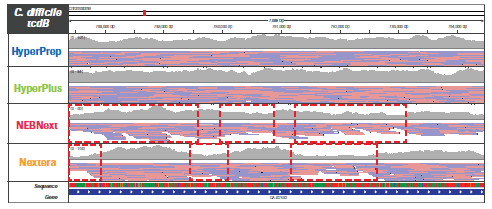
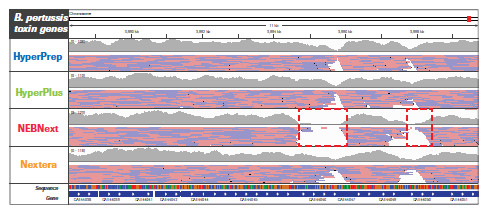
不同的文库构建方法对基因组特定区域更局部的影响。采用 HyperPrep 和 HyperPlus,每种微生物的每个区域都实现了类似且高度均一的覆盖度。而其他产品的比对读数分布不均匀,尤其是AT-富集的C. difficile毒力基因。另外,其他产品在GC-富集的B. pertussis毒力基因编码区域中有两个明显缺口,无读数可用。(数据来源于罗氏总部)
最后,在de novo测序上,KAPA试剂盒也体现出了一定的优越性,具体表现在contig的数量最低,contig的最长长度和N50长度都高于同类产品,这使得后期拼接组装更容易。
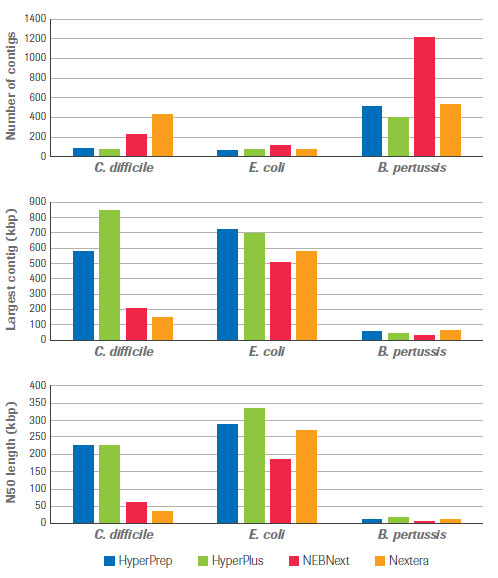
对4种文库构建方法的关键 de novo 组装指标进行比较,包括 contig 的数量,最长 contig 的长度和 N50 长度。HyperPrep 和 HyperPlus 在所有指标上均优于其他产品。(数据来源于罗氏诊断总部)
从以上实例中,你是不是已经感受到了“定向进化”的威力了呢?
心动不如行动,点击下方的阅读原文链接,去KAPA官网了解更多的应用信息,或长按以下图片,识别二维码,参与到KAPA试用体验的活动中来吧!
阅读原文链接:
http://lifescience.roche-diagnostics.cn/index.aspx
“爱TA 就送 TA KAPA”试用活动二维码:





 电话
电话 主页
主页 留言
留言